Bonjour,
La force ionique est une caractéristique de l'activité des ions en solutions, ce n'est donc pas lié à un ion en particulier mais à ce qui se passe autour (son atmosphère ionique). Pour une solution de concentration $c_i$ d'ion $i$ de charge $z_i$, la force ionique $I$ est définie par $$I=\frac{1}{2} \sum_{i} c_i z_i^2$$
Pour les protéines, on a souvent une courbe avec un maximum lorsqu'on augmente la teneur en sels (donc la force ionique) :
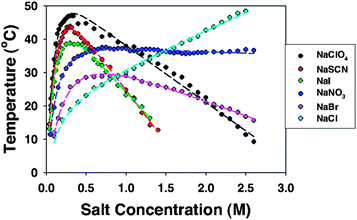
Calculs théoriques sur l'effet de la force ionique en fonction du sel choisi (séries de Hofmeister)$^{[1]}$
Décrivons le comportement classique :
- A faible force ionique, les contre-ions vont pouvoir entourer de manière efficace la protéine et donc favoriser sa solutilité. C'est la phase dite "salting in".
- A forte force ionique, il y a tellement d'ions qu'il y a compétition entre les ions et la protéine pour s'accaparer le solvant. La protéine devient de moins en moins soluble lorsque la force ionique augmente : c'est le "salting out".
C'est sur ce principe que fonctionnent la majorité des techniques de cristallisation de protéines. On utilise aussi d'autres agents précipitants comme le PEG (pour les grosses protéines, on utilise surtout les composés organiques type PEG, pour les petites protéines surtout les sels).
Illustrations :
$[1]$ M. T. Record, E. Guinn, L. Pegrama et M. Capp, "Introductory Lecture: Interpreting and predicting Hofmeister salt ion and solute effects on biopolymer and model processes using the solute partitioning model",
Faraday Discuss.,
2013,160, p 9-44
