Bonsoir,
Dans la spectroscopie UV-visible, il est clair que les spectres d'absorption présente des bandes d'absorption avec un maximum d'absorption pour une longueur d'onde maximale. Cependant, m'appuyant sur le faite que l'absorption de la lumière se fait par l'électron lors de sa transition entre un niveau d'énergie et un autre on devrait avoir un pic d'absorption pour lambda max et zéro ailleurs (puisque l'électron absorbe une longueur d'onde mais pas les autres). Pourquoi est-ce autrement ?
Merci
Depuis le 1er avril 2022, ce forum devient accessible uniquement en lecture. (Voir ce message)
Il n'est plus possible de s'y inscrire, de s'y connecter, de poster de nouveaux messages ou d'accéder à la messagerie privée. Vous pouvez demander à supprimer votre compte ici.
Il n'est plus possible de s'y inscrire, de s'y connecter, de poster de nouveaux messages ou d'accéder à la messagerie privée. Vous pouvez demander à supprimer votre compte ici.
Absorption uv-visible
-
tuttifrutties
- Messages : 4
- Inscription : 05/02/2016, 20:56
- Niveau d'étude / Domaine : 3ème année licence
-
darrigan
- Administrateur

- Messages : 2548
- Inscription : 16/03/2011, 15:48
- Niveau d'étude / Domaine : Docteur en chimie physique
- Localisation : Pau (64), France
- Contact :
Re: Absorption uv-visible
Bonjour,
En effet, la transition en UV-visible correspond au passage d'un électron du niveau électronique fondamental vers un niveau électronique excité. Et cela correspondrait à un pic.
Mais il ne faut pas oublier plusieurs choses :
- Il existe des niveaux vibrationnels pour chacun des états électroniques. Ces niveaux sont plus proches les uns des autres. Il peut donc y avoir des transitions entre différents niveaux vibrationnels de l'état fondamental vers différents niveaux vibrationnels d'un état excité. En général, à température ambiante, on peut considérer que seul le niveau vibrationnel fondamental de l'état électronique fondamental est peuplé. Mais la transition peut arriver sur un niveau vibrationnel excité de l'état excité.
- Les molécules vibrent en permanence, c'est-à-dire qu'à un instant précis, leur géométrie n'est pas la géométrie la plus stable théoriquement. Imagine une molécule qui vibre selon plusieurs modes de vibration… Une transition électronique dure environ $10^{-15}$ secondes, ce qui est bien plus court qu'une déformation par vibration.
- En phase condensée (liquide), les molécules sont en interaction forte les unes des autres, ce qui contribue aussi à modifier légèrement les niveaux énergétiques des molécules, et donc un élargissement des bandes.
- Il peut aussi y avoir des bandes d'absorption proches les unes des autres, ce qui donne des bande larges ou avec épaulements sur le spectre.
Le spectre enregistré est alors une contribution de milliards de milliards de molécules qui sont chacune dans une géométrie proche de la géométrie d'équilibre, mais cela donne un certain élargissement des bandes spectrales. Et à cela s'ajoute aussi les transitions prenant en compte les différents niveaux vibrationnels.
La résolution du spectromètre est importante aussi…
En effet, la transition en UV-visible correspond au passage d'un électron du niveau électronique fondamental vers un niveau électronique excité. Et cela correspondrait à un pic.
Mais il ne faut pas oublier plusieurs choses :
- Il existe des niveaux vibrationnels pour chacun des états électroniques. Ces niveaux sont plus proches les uns des autres. Il peut donc y avoir des transitions entre différents niveaux vibrationnels de l'état fondamental vers différents niveaux vibrationnels d'un état excité. En général, à température ambiante, on peut considérer que seul le niveau vibrationnel fondamental de l'état électronique fondamental est peuplé. Mais la transition peut arriver sur un niveau vibrationnel excité de l'état excité.
- Les molécules vibrent en permanence, c'est-à-dire qu'à un instant précis, leur géométrie n'est pas la géométrie la plus stable théoriquement. Imagine une molécule qui vibre selon plusieurs modes de vibration… Une transition électronique dure environ $10^{-15}$ secondes, ce qui est bien plus court qu'une déformation par vibration.
- En phase condensée (liquide), les molécules sont en interaction forte les unes des autres, ce qui contribue aussi à modifier légèrement les niveaux énergétiques des molécules, et donc un élargissement des bandes.
- Il peut aussi y avoir des bandes d'absorption proches les unes des autres, ce qui donne des bande larges ou avec épaulements sur le spectre.
Le spectre enregistré est alors une contribution de milliards de milliards de molécules qui sont chacune dans une géométrie proche de la géométrie d'équilibre, mais cela donne un certain élargissement des bandes spectrales. Et à cela s'ajoute aussi les transitions prenant en compte les différents niveaux vibrationnels.
La résolution du spectromètre est importante aussi…
Aide-toi et le forum t'aidera ! 
-
brusicor02
- Messages : 506
- Inscription : 09/02/2012, 18:09
- Niveau d'étude / Domaine : M2 Chimie - magistère PCM d'Orsay
- Localisation : Lyon, FRANCE
- Remarque : Ancien pseudonyme : RuBisCO
- Contact :
Re: Absorption uv-visible
Pour compléter de manière visuelle les propos de darrigan, prenons le spectre infrarouge de l'éthanol : 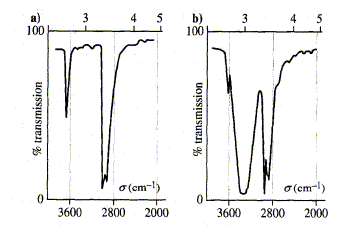

-
tuttifrutties
- Messages : 4
- Inscription : 05/02/2016, 20:56
- Niveau d'étude / Domaine : 3ème année licence
Re: Absorption uv-visible
C'est plus clair à présent. Merci pour vos réponses.