Depuis le 1er avril 2022, ce forum devient accessible uniquement en lecture. (Voir ce message)
Il n'est plus possible de s'y inscrire, de s'y connecter, de poster de nouveaux messages ou d'accéder à la messagerie privée. Vous pouvez demander à supprimer votre compte ici.
Il n'est plus possible de s'y inscrire, de s'y connecter, de poster de nouveaux messages ou d'accéder à la messagerie privée. Vous pouvez demander à supprimer votre compte ici.
[Synthèse] De la Curcumine à la Vanilline
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
[Synthèse] De la Curcumine à la Vanilline
Bonjour à tous,
Dans un but scolaire nous venons d'extraire de la Curcumine du curcuma, pour en faire de la vanilline...
D'après ce que j'ai pu lire c'était "par oxydation de la curcumine" et je n'est pu trouver plus d'information à ce sujet ?
Alors je pense bien que l'oxydation va jouer avec les cétones de la curcumine pour séparer cette molécule en deux... Mais je n'ai nul part trouver de détail à ce sujet ?
J'aimerai me préparer à ce TP un peu, histoire de voir de quoi on parle ^^
(Alors par contre j'ai trouver une demi-douzaine de d'autre base pour le faire, clou de giroffles/eugenole puis avec du benzène en phénol etc.... mais rien là dessus.)
Merci à tous d'avance !
Dans un but scolaire nous venons d'extraire de la Curcumine du curcuma, pour en faire de la vanilline...
D'après ce que j'ai pu lire c'était "par oxydation de la curcumine" et je n'est pu trouver plus d'information à ce sujet ?
Alors je pense bien que l'oxydation va jouer avec les cétones de la curcumine pour séparer cette molécule en deux... Mais je n'ai nul part trouver de détail à ce sujet ?
J'aimerai me préparer à ce TP un peu, histoire de voir de quoi on parle ^^
(Alors par contre j'ai trouver une demi-douzaine de d'autre base pour le faire, clou de giroffles/eugenole puis avec du benzène en phénol etc.... mais rien là dessus.)
Merci à tous d'avance !
-
ecolami
- Contributeur d'Or 2011+2012

- Messages : 2521
- Inscription : 21/03/2011, 14:09
- Niveau d'étude / Domaine : DUT CHIMIE
- Localisation : Seine et Marne, France
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
bonsoir,
J'ai trouve ce lien http://fr.answers.yahoo.com/question/in ... 346AAeGl9M ou la conversion en vaniline est un peu détaillée.
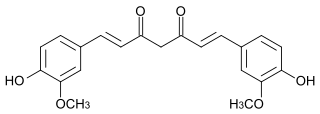
Je ne sais pas si c'est possible mais j'observe une similitude avec l'aldéhyde cinnamique et quand on sait qu'il est obtenu par action de benzaldéhyde sur de l'Ethanal on peut imaginer une réaction inverse: dans l'idéal les 2 doubles liaisons -CH=CH- seraient ouvertes et formeraient des aldéhydes.
J'ai trouve ce lien http://fr.answers.yahoo.com/question/in ... 346AAeGl9M ou la conversion en vaniline est un peu détaillée.

Je ne sais pas si c'est possible mais j'observe une similitude avec l'aldéhyde cinnamique et quand on sait qu'il est obtenu par action de benzaldéhyde sur de l'Ethanal on peut imaginer une réaction inverse: dans l'idéal les 2 doubles liaisons -CH=CH- seraient ouvertes et formeraient des aldéhydes.
Tri+traitement Produits chimiques 77 (Seine et Marne). Retraité depuis Octobre 2015
http://ami.ecolo.free.fr
http://ami.ecolo.free.fr
-
Klem
- Messages : 84
- Inscription : 05/04/2011, 13:17
- Niveau d'étude / Domaine : Master Pro synthèse et analyse organique
- Localisation : Bâle, CH
Re: [Synthèse] De la Curcumine à la Vanilline
Par ozonolyse c'est peut être possible...
Klem (anciennement Mad-Chemist)
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Merci pour vos réponse, donc ça reste une synthèse assez inovatrice ? Et pas "bateau" comme je l'aurai crus ^^ wah.
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Je me permet de deterrer le sujet, car ce matin on vient de réaliser la synthèse... le Problème étant que ce qui est géniale dans ma séction, rien n'est expliqué...
On a versé dans notre Curcumine (purifier par ColChroma) De l'H2SO4; H2O2(Principales réactids lors d'une oxydation)
Mais on a aussi ajouté :
-200 mg de MgSO4 (hydraté...)
-200mg de KHSO4
-50 mg de CuCl2 (hydraté)
-120 mg d'Acetate de sodium.3H2O
Ce qui m'embete c'est de ne rien, jamais rien, avoir d'écrit (Décris aussi) au tableau... On nous apprend un peu à l'improviste, sans jamais comprendre vraiment... Quelqu'un pourrait me donner à peu de chose près les rôles potentiels de ces réactifs ?
Ou encore me dirigé
On a versé dans notre Curcumine (purifier par ColChroma) De l'H2SO4; H2O2(Principales réactids lors d'une oxydation)
Mais on a aussi ajouté :
-200 mg de MgSO4 (hydraté...)
-200mg de KHSO4
-50 mg de CuCl2 (hydraté)
-120 mg d'Acetate de sodium.3H2O
Ce qui m'embete c'est de ne rien, jamais rien, avoir d'écrit (Décris aussi) au tableau... On nous apprend un peu à l'improviste, sans jamais comprendre vraiment... Quelqu'un pourrait me donner à peu de chose près les rôles potentiels de ces réactifs ?
Ou encore me dirigé
-
ecolami
- Contributeur d'Or 2011+2012

- Messages : 2521
- Inscription : 21/03/2011, 14:09
- Niveau d'étude / Domaine : DUT CHIMIE
- Localisation : Seine et Marne, France
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Bonjour,
Je ne connais pas les détails mais je pense qu'une partie des ingrédients sont pour tamponner le ph. Par contre le Chlorure de Cuivre II est un activateur qui catalyse la destruction de l'eau oxygénée et donc la libération d'oxygène "actif".
Le Sulfate de magnésium me laisse perplexe.
Je m'interroge aussi sur le rôle du Sulfate acide de Potassium par rapport à l'Acide sulfurique ET à l'Acétate de Sodium: je pense qu'il est en trop, en adaptant le dosage en sel d'acide faible on doit obtenir le même résultat.
Je ne connais pas les détails mais je pense qu'une partie des ingrédients sont pour tamponner le ph. Par contre le Chlorure de Cuivre II est un activateur qui catalyse la destruction de l'eau oxygénée et donc la libération d'oxygène "actif".
Le Sulfate de magnésium me laisse perplexe.
Je m'interroge aussi sur le rôle du Sulfate acide de Potassium par rapport à l'Acide sulfurique ET à l'Acétate de Sodium: je pense qu'il est en trop, en adaptant le dosage en sel d'acide faible on doit obtenir le même résultat.
Tri+traitement Produits chimiques 77 (Seine et Marne). Retraité depuis Octobre 2015
http://ami.ecolo.free.fr
http://ami.ecolo.free.fr
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
D'accord, c'est une bonne explication ! Merci 
Donc il me reste à Savoir pour KHSO4 et MgSO4 principalement...
d'autant plus qu'il est hydratée et avec eau en excès donc bon sa seul utilité que j'en avais était sont action desséchante. là ...
Donc il me reste à Savoir pour KHSO4 et MgSO4 principalement...
d'autant plus qu'il est hydratée et avec eau en excès donc bon sa seul utilité que j'en avais était sont action desséchante. là ...
-
alexchimiste
- Messages : 829
- Inscription : 04/04/2011, 09:48
- Niveau d'étude / Domaine : DUT chimie
- Localisation : Strasbourg
Re: [Synthèse] De la Curcumine à la Vanilline
Une réponse fort simple : à rien, on te fait faire de la merde... Aucune de ces substances ne peut permettre une rupture de la double liaison carbone-carbone essentielle à la formation de ta vanilline attendue.Blackline a écrit :Je me permet de deterrer le sujet, car ce matin on vient de réaliser la synthèse... le Problème étant que ce qui est géniale dans ma séction, rien n'est expliqué...
On a versé dans notre Curcumine (purifier par ColChroma) De l'H2SO4; H2O2(Principales réactids lors d'une oxydation)
Mais on a aussi ajouté :
-200 mg de MgSO4 (hydraté...)
-200mg de KHSO4
-50 mg de CuCl2 (hydraté)
-120 mg d'Acetate de sodium.3H2O
Ce qui m'embete c'est de ne rien, jamais rien, avoir d'écrit (Décris aussi) au tableau... On nous apprend un peu à l'improviste, sans jamais comprendre vraiment... Quelqu'un pourrait me donner à peu de chose près les rôles potentiels de ces réactifs ?
Ou encore me dirigé
En l'occurrence, produire de la vanilline à partir de curcumine me semble moyennement facile à engager... Tu peux envisager une oxydation douce de la double liaison en aldéhyde, avec le réactif de Sarrett, je pense que c'est possible... Le réactif de Sarrett c'est du trioxyde de chrome (VI) en milieu sulfurique concentré, normalement ça permet d'oxyder et de s'arrêter à l'aldéhyde. Sinon oxydation brutale avec du permanganate de potassium en milieu sulfurique à chaud, puis réduction de l'acide carboxylique avec du LiAlH4, ce qui conduira à l'alcool vanillique, puis réoxydation douce en aldéhyde, avec de l'acide 2-iodoxybenzoïque dans le DMSO. Cela me semble plus indiqué.
-
Kevin
- Messages : 158
- Inscription : 19/03/2011, 19:58
- Niveau d'étude / Domaine : Docteur en électrochimie organique
- Localisation : Astana Kazakhstan / Burlington VT - USA
Re: [Synthèse] De la Curcumine à la Vanilline
La question principale : est ce que tu as obtenu de la vanilline avec ton mélange oxydant? KHSO4/AcONa/H2SO4 doit servir à faire un tampon un peu étrange, mais un tampon quand même...
H2O2 s'additionne en 1,4 sur l'énone (comme dans une époxydation) et le cuivre vient faciliter le clivage de la liaison O-OH pour former un radical O* sur ta molécule. Celui-ci va former l'aldéhyde de la vanilline et cliver la liaison C-C adjacente.
Chose surprenante (si la réaction fonctionne...) c'est qu'il n'y a pas oxydation du phénol. Où alors c'est un autre mécanisme qui a lieu...
H2O2 s'additionne en 1,4 sur l'énone (comme dans une époxydation) et le cuivre vient faciliter le clivage de la liaison O-OH pour former un radical O* sur ta molécule. Celui-ci va former l'aldéhyde de la vanilline et cliver la liaison C-C adjacente.
Chose surprenante (si la réaction fonctionne...) c'est qu'il n'y a pas oxydation du phénol. Où alors c'est un autre mécanisme qui a lieu...
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Alors je ne sais pas du tout ce que j'ai obtenue à la suite (déjà parce que j'ai pas de nez) mais surtout parce que le temps nous manquait. Mais à en croire la prof, (elle nous a tout verser dans la bouche...On y a gobé)
C'était bon. D'autant plus qu'elle n'explique rien de chez rien... C'est hard. les seul papier qu'on a avec une synthèse écrite est celle à partir de l'eugénol (Clou de Girofles me semble-t-il) donc... Totalement HS.
Merci pour explications nombreuse
C'était bon. D'autant plus qu'elle n'explique rien de chez rien... C'est hard. les seul papier qu'on a avec une synthèse écrite est celle à partir de l'eugénol (Clou de Girofles me semble-t-il) donc... Totalement HS.
Merci pour explications nombreuse
-
Klem
- Messages : 84
- Inscription : 05/04/2011, 13:17
- Niveau d'étude / Domaine : Master Pro synthèse et analyse organique
- Localisation : Bâle, CH
Re: [Synthèse] De la Curcumine à la Vanilline
La prof est une incompétente... 
Klem (anciennement Mad-Chemist)
-
ecolami
- Contributeur d'Or 2011+2012

- Messages : 2521
- Inscription : 21/03/2011, 14:09
- Niveau d'étude / Domaine : DUT CHIMIE
- Localisation : Seine et Marne, France
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Bonsoir,
Est-ce que la couleur de la curcumine avait disparu? La vanilline est incolore.
Concernant cette prof il est inadmissible de ne pas fournir des informations détaillées pour une synthèse et en particulier décrire le rôle des ingrédients et des conditions opératoires (agitation, température, temps de réaction etc...)Sinon ce n'est plus de la science.
L'interêt pratique de convertir de la curcumine ou de l'eugénol en vanilline est assez nul étant donné le prix des produits de départ!
Encore aujourd'hui la vaniline de synthèse est en concurrence avec la vaniline naturelle.
Est-ce que la couleur de la curcumine avait disparu? La vanilline est incolore.
Concernant cette prof il est inadmissible de ne pas fournir des informations détaillées pour une synthèse et en particulier décrire le rôle des ingrédients et des conditions opératoires (agitation, température, temps de réaction etc...)Sinon ce n'est plus de la science.
L'interêt pratique de convertir de la curcumine ou de l'eugénol en vanilline est assez nul étant donné le prix des produits de départ!
Encore aujourd'hui la vaniline de synthèse est en concurrence avec la vaniline naturelle.
Tri+traitement Produits chimiques 77 (Seine et Marne). Retraité depuis Octobre 2015
http://ami.ecolo.free.fr
http://ami.ecolo.free.fr
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Petit lundi matin à 9h :
On arrive en cours, nos Ballon (quadricol sans raison) Sont disposé avec la curcumine à l'interieur.
On y place un elevateur + Chauffe ballon.
On verse 4 Tube à essaie pré-pesé dedans, 2 petites fioles avec H2O2 et H2SO4
Puis en met 100mL d'eau...
On sait qu'on met un refrigérant à eau au dessus pour récuperer l'eau pour eviter que le tout caramélise, je demande 2-3 explications en me faisant remballer... Donc à force de faire abstrait Bah... On laisse faire.
Donc 45 minute passe, on a un Milieu réactionnel assez brouillons, on lui met 30mL de dichlo (cette fois on le mesure youpi, un peu de manip que diable) et on décante 3 fois avec de nouveau 30mL de C2H2Cl2 Puis on obtient un Solvant + Phase Orga... Assez jaune ? pas transparente, n'ayant pas de nez je ne saurais dit l'odeur de la fiole, d'autant qu'avec du Dchlo j'évite de sniffer les fioles. Donc on passe au rotavap ... et ça sonne donc on degerpi, le café oblige.
Voilà le topo final... Donc voyez que la phase explicative est très surfaite...
Incompétente de je sais pas; elle a un Doctorat, mais apprement ça ne veut rien dire, voir l'inverse. Mes profs les plus compétant on des master d'après mes Statistiques ahah !
On arrive en cours, nos Ballon (quadricol sans raison) Sont disposé avec la curcumine à l'interieur.
On y place un elevateur + Chauffe ballon.
On verse 4 Tube à essaie pré-pesé dedans, 2 petites fioles avec H2O2 et H2SO4
Puis en met 100mL d'eau...
On sait qu'on met un refrigérant à eau au dessus pour récuperer l'eau pour eviter que le tout caramélise, je demande 2-3 explications en me faisant remballer... Donc à force de faire abstrait Bah... On laisse faire.
Donc 45 minute passe, on a un Milieu réactionnel assez brouillons, on lui met 30mL de dichlo (cette fois on le mesure youpi, un peu de manip que diable) et on décante 3 fois avec de nouveau 30mL de C2H2Cl2 Puis on obtient un Solvant + Phase Orga... Assez jaune ? pas transparente, n'ayant pas de nez je ne saurais dit l'odeur de la fiole, d'autant qu'avec du Dchlo j'évite de sniffer les fioles. Donc on passe au rotavap ... et ça sonne donc on degerpi, le café oblige.
Voilà le topo final... Donc voyez que la phase explicative est très surfaite...
Incompétente de je sais pas; elle a un Doctorat, mais apprement ça ne veut rien dire, voir l'inverse. Mes profs les plus compétant on des master d'après mes Statistiques ahah !
-
ecolami
- Contributeur d'Or 2011+2012

- Messages : 2521
- Inscription : 21/03/2011, 14:09
- Niveau d'étude / Domaine : DUT CHIMIE
- Localisation : Seine et Marne, France
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
bonsoir,
Interessant de savoir comment ça s'est passé!
Tu dis que cette prof a un doctorat, peut-être ne fait-elle ce boulot que parce qu'elle n'a rien trouvé de plus interessant (pour elle) à faire? Manifestement elle ne s'interesse pas du tout à l'enseignement! C'est dommage, je pense qu'on doit tout de même trouver des personnes qui aiment enseigner et surtout qui aiment ce qu'ils enseignent.
Remarque: quand on veut savoir si un mélange de solvant contient une substance odorante sans avoir à tout passer en distillation on peut prendre une bande de papier. En la trempant on peut ensuite évaporer le solvant et sentir. Cela se fait en quelques secondes.
Interessant de savoir comment ça s'est passé!
Tu dis que cette prof a un doctorat, peut-être ne fait-elle ce boulot que parce qu'elle n'a rien trouvé de plus interessant (pour elle) à faire? Manifestement elle ne s'interesse pas du tout à l'enseignement! C'est dommage, je pense qu'on doit tout de même trouver des personnes qui aiment enseigner et surtout qui aiment ce qu'ils enseignent.
Remarque: quand on veut savoir si un mélange de solvant contient une substance odorante sans avoir à tout passer en distillation on peut prendre une bande de papier. En la trempant on peut ensuite évaporer le solvant et sentir. Cela se fait en quelques secondes.
Tri+traitement Produits chimiques 77 (Seine et Marne). Retraité depuis Octobre 2015
http://ami.ecolo.free.fr
http://ami.ecolo.free.fr
-
Kevin
- Messages : 158
- Inscription : 19/03/2011, 19:58
- Niveau d'étude / Domaine : Docteur en électrochimie organique
- Localisation : Astana Kazakhstan / Burlington VT - USA
Re: [Synthèse] De la Curcumine à la Vanilline
Apparemment n'importe quoi oxyde la curcumine en vanilline...
http://archive.org/stream/americanchemi ... 8/mode/2up
http://archive.org/stream/americanchemi ... 8/mode/2up
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Exact c'est pourquoi je disais trouver les Professeurs qui ont toujours voulu faire ce metier un peu plus interessant, Après avoir fais un Doctorat, ils s'attendaient à la Recherche, les prix nobel ou autre...ecolami a écrit : Tu dis que cette prof a un doctorat, peut-être ne fait-elle ce boulot que parce qu'elle n'a rien trouvé de plus interessant (pour elle) à faire? Manifestement elle ne s'interesse pas du tout à l'enseignement!
Mais la réalité étant toute autre, ils ont devenus plus aigris et refractaire à leur propre science ! Car depuis la réforme de la séction STL, bah elle doit pas rigoler... Si c'est ça les cours de chimie, Mieux vaut s'arreter à la licence pour être prof quoi...
Donc elle doit surement trouver ça trop succint, et s'éccarter elle même de la chimie ?
Enfin, ce qui m'embete le plus c'est que l'on a 3h de Spécialité seulement par semaine, et donc c'est très contraignant si on y apprend jamais rien (A part à nous filer 20 pages inutile par séance...)
Parce que la Feuille où était situé la synthèse à partir de l'eugénol, il y avait aussi notre TP de décrit (en mode recette de cuisine) Mais a part ça, bah tout un tas d'autre TP relatif à la Vanilline inexpliqué (pour cette solution plutot qu'une autre) , des représentation Topo de vanilline (aucune de la curcumine) sachant que ma classe ne sait pas lire les formules topologique... Je vois explique pas les situations bien Kafkaïenne !
-
alexchimiste
- Messages : 829
- Inscription : 04/04/2011, 09:48
- Niveau d'étude / Domaine : DUT chimie
- Localisation : Strasbourg
Re: [Synthèse] De la Curcumine à la Vanilline
Peut être qu'elle fait ce qu'elle peut, mais bon je trouve ça assez inadmissible, c'est complètement contraire aux fondements mêmes de la démarche scientifique.ecolami a écrit : Tu dis que cette prof a un doctorat, peut-être ne fait-elle ce boulot que parce qu'elle n'a rien trouvé de plus interessant (pour elle) à faire? Manifestement elle ne s'interesse pas du tout à l'enseignement!
-
darrigan
- Administrateur

- Messages : 2548
- Inscription : 16/03/2011, 15:48
- Niveau d'étude / Domaine : Docteur en chimie physique
- Localisation : Pau (64), France
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Bonjour 
Hé là ! Oh ! On tape pas ainsi sur les Docteurs ! Un doctorat c'est souvent un travail de recherche sur un sujet très très pointu et bien éloigné des enseignements de TP que l'on donne à un enseignant fraichement recruté. Croyez-vous que c'est elle qui a choisi quelles manips seraient faites en TP et comment on les feraient ? Bien souvent un TP peut rester le même pendant 10 ans (ou 30 ans...), si personne ne se préoccupe de le remplacer par un autre, et donc de passer du temps à en tester d'autres. Dans une fac, c'est triste à dire, mais la majorité des enseignants-chercheurs préfèrent s'investir dans la recherche, pour avancer plus vite dans leur carrière, qu'en enseignement. Avant de s'emballer, il faudrait connaitre exactement le contexte de ce TP, de cette fac, de ce prof, et ne surtout pas tirer des généralités trop rapides. (Mais le forum n'est pas là pour ça)
Bon cela dit, je suis d'accord avec vous, je trouve curieux que tout soit "prêt à verser" dans des tubes, tout déjà en place, y a plus qu'à verser et attendre... À tel point que la moindre mesure avec une éprouvette devient vite LE moment tant inespéré par les étudiants ! Sans compter tout ce mélange de réactifs improbable pour aboutir à de la vanilline.
Sans compter tout ce mélange de réactifs improbable pour aboutir à de la vanilline.  c'est triste.
c'est triste.
Hé là ! Oh ! On tape pas ainsi sur les Docteurs ! Un doctorat c'est souvent un travail de recherche sur un sujet très très pointu et bien éloigné des enseignements de TP que l'on donne à un enseignant fraichement recruté. Croyez-vous que c'est elle qui a choisi quelles manips seraient faites en TP et comment on les feraient ? Bien souvent un TP peut rester le même pendant 10 ans (ou 30 ans...), si personne ne se préoccupe de le remplacer par un autre, et donc de passer du temps à en tester d'autres. Dans une fac, c'est triste à dire, mais la majorité des enseignants-chercheurs préfèrent s'investir dans la recherche, pour avancer plus vite dans leur carrière, qu'en enseignement. Avant de s'emballer, il faudrait connaitre exactement le contexte de ce TP, de cette fac, de ce prof, et ne surtout pas tirer des généralités trop rapides. (Mais le forum n'est pas là pour ça)
Bon cela dit, je suis d'accord avec vous, je trouve curieux que tout soit "prêt à verser" dans des tubes, tout déjà en place, y a plus qu'à verser et attendre... À tel point que la moindre mesure avec une éprouvette devient vite LE moment tant inespéré par les étudiants !
Aide-toi et le forum t'aidera ! 
-
Blackline
- Messages : 257
- Inscription : 23/01/2012, 07:51
- Niveau d'étude / Domaine : Agrégation de chimie
- Localisation : Strasbourg
- Contact :
Re: [Synthèse] De la Curcumine à la Vanilline
Le problème est que c'est toujours comme ça... Et elle choisit les TP elle le dit elle même.
On avait commencer par Epinard ---> Chlorophyle, on s'est arreté à l'étape Buchner Solvant. Pas de Chromatographie sur colonne, par d'explication non plus.
Moi je le prend assez mal, mais le pire c'est mes camarades qui apprennent par exemple "1 vis + 1 boulon = 1 écrous"
Phrase dites par la prof pour illustrer notre 3èm cours consécutif sur les Tableaux d'avancement.
Bien sur je dis ça juste pour situer le contexte de l'abstrait.
Un doctorat reste effectivement 8 ans d'études, de recherche etc... Mais elle est prof de lycée, donc à part nous faire cours aux lycéens...
On avait commencer par Epinard ---> Chlorophyle, on s'est arreté à l'étape Buchner Solvant. Pas de Chromatographie sur colonne, par d'explication non plus.
Moi je le prend assez mal, mais le pire c'est mes camarades qui apprennent par exemple "1 vis + 1 boulon = 1 écrous"
Phrase dites par la prof pour illustrer notre 3èm cours consécutif sur les Tableaux d'avancement.
Bien sur je dis ça juste pour situer le contexte de l'abstrait.
Un doctorat reste effectivement 8 ans d'études, de recherche etc... Mais elle est prof de lycée, donc à part nous faire cours aux lycéens...